Dernière mise à jour: février 2022
Récemment, de nouveaux produits issus de plantes de cannabis ont vu le jour sur le marché belge et français : des produits à base de cannabidiol (CBD). Le CBD est un cannabinoïde que l’on retrouve à l’état naturel dans les fleurs de cannabis, dans des proportions variables selon les variétés cultivées. Contrairement au THC, il n’induit pas d’effets psychotropes et agit d’ailleurs comme léger antagoniste des récepteurs cannabinoïdes: le CBD est ainsi connu pour atténuer certains effets du THC, en particulier ses effets anxiogènes et psychotiques (délires, hallucinations, paranoïa, etc. ; Zuardi et al., 2012). Il agit également comme inhibiteur de la recapture de l’anandamide (un cannabinoïde endogène) et en retarde la dégradation (ce qui contribue aussi à la réduction des effets du THC), et il a également une action indirecte sur certains récepteurs à la sérotonine ainsi que sur certains récepteurs opioïdes (ce qui expliquerait notamment son utilité dans le traitement de la douleur).
Les produits à base de CBD (fleurs de cannabis, e-liquid, extraits pour tisane, etc.) sont vendus dans des boutiques spécialisées ou sur Internet de manière transparente. Ils profitent le plus souvent d’une zone grise du droit européen et/ou de sa traduction en droit national. En effet, l’Union Européenne a instauré une tolérance vis-à-vis de la culture de chanvre de manière à ne pas entraver son utilisation à des fins industrielles ou commerciales, tout en empêchant la commercialisation de produits psychoactifs, et ce en n’autorisant uniquement la culture de variétés de chanvre qui ne contiennent pas plus de 0,2% de THC (0,3% depuis fin 2021). En Belgique, le droit européen s’est traduit de la manière suivante : l’arrêté ministériel du 27 juillet 2011 et l’arrêté-royal du 26 septembre 2017 mentionnent que seuls les produits du cannabis dont les concentrations cumulées de delta-9-tetrahydrocannabinol (THC) et de l’acide tetrahydrocannabinolique (THCA) dépassent le seuil de 0,2% sont interdits. Par conséquent, les produits à base de CBD ne dépassant pas ce seuil ne sont pas formellement interdits sur base des lois sur les drogues, quelles que soient leur forme (herbe, résine, huile, bonbon, etc.), ni sur base de celle de la culture de chanvre. Ce n’est pas pour autant que les produits à base de CBD peuvent être légalement vendus pour un usage humain. En effet, selon l’arrêté-royal du 29 août 1997, l’utilisation de la plante de Cannabis Sativa L. (dont est extrait le CBD) n’est pas autorisée dans les denrées alimentaires. L’AFSCA signale toutefois que des dérogations peuvent être accordées par le SPF Santé Publique pour autant que des analyses démontrent bien l’absence de substances toxiques dans les lots commercialisés. Ces produits ne peuvent non plus être vendus dans ces boutiques pour un usage médical. Cela explique pourquoi ils sont généralement vendus sans en venter les propriétés thérapeutiques, afin de ne pas tomber sous le coup d’un exercice illégal de l’art médical ou de l’art pharmaceutique. Et du côté de pharmacies, un arrêté royal de juin 2015 leur interdit de délivrer des préparations magistrales contenant du THC, même s’il ne s’agit que de trace. Or il est difficile d’exclure toute trace de THC dans les produits à base de CBD étant donné l’origine végétale commune des deux cannabinoïdes. Par conséquent, les pharmaciens ne sont pas autoriser à vendre des préparations magistrales à base de CBD au regard de la loi belge. Mais comme on va leur voir ci-après, les choses se sont un peu assouplie récemment… Les produits à base de CBD ne peuvent non plus être légalement vendus sous forme de produits cosmétiques, car le droit européen n’autorise que les extraits de graines et de feuilles de cannabis dans ces produits (or le CBD est essentiellement contenu dans les sommités fleuries). Seuls les produits destinés à une consommation par le biais de cigarette électronique échappent actuellement aux législations en vigueur. Mais les vendeurs peuvent également jouer la carte de l’hypocrisie en spécifiant que ces produits ne sont pas destinés à la consommation humaine… Le risque de poursuite est dès lors infime, pour autant que les produits ne contiennent pas plus de 0,2% de THC et qu’aucun incident lié à leur consommation ne leur soit reproché…
De récents changements ont toutefois eut lieu pour le CBD en Belgique:
- En avril 2019, le SPF Finances s’est positionné en énonçant que les produits à base de CBD destinés à être fumés sont désormais considérés comme des « autres tabac à fumer » et doivent se soumette à leur régime d’étiquetage, de taxation et de conditions de mise sur le marché. Si cette décision permet de poser un cadre légal pour le marché du CBD destiné à être fumé, elle va considérablement impacter le prix du produit (et entraîner la fermeture de nombreux CBD shops). En outre, ce positionnement laisse dans la zone grise tous les autres produits à base de CBD (huile, confiserie, etc.).
- En août 2019, l’Agence fédérale des médicaments et des produits de santé (AFMPS) a publié une circulaire précisant que les pharmaciens sont désormais autorisés à vendre des préparations magistrales à base de CBD, mais uniquement sur prescription médicale, et pour autant que la quantité de THC d’une dose journalière ne dépasse pas 1 microgramme par kg de masse corporelle. Aucun remboursement n’est actuellement prévu, de sorte que ces préparations sont relativement coûteuses pour les patients et peu attractives par rapport à ce qui est vendu dans les CBD shops ou sur Internet.
- Depuis février 2020, le laboratoire Amophar commercialise une huile de CBD dans les pharmacies belges, accessible sans ordonnance. Le produit est vendu comme destiné à « usage externe », de manière à contourner l’absence d’accord de commercialisation en tant que produit en vente libre et à usage interne… Ce positionnement commercial a l’avantage de rendre le CBD « pharmaceutique » plus accessible et moins onéreux, et permet au public d’avoir accès à un produit contrôlé et standardisé, que l’on retrouve plus aléatoirement dans les CBD shops. A notre connaissance, l’AFMPS ne s’est pas encore positionnée par rapport à cette stratégie de mise sur le marché.
Dans un CBD shops, le prix d’un gramme de fleurs de cannabis au CBD est égal ou légèrement supérieur au prix d’un gramme de cannabis sur le marché noir. Les produits à base de CBD sont le plus souvent importés de Suisse, où leur production et leur commerce y sont implantés depuis plusieurs années, mais une production belge est théoriquement possible.
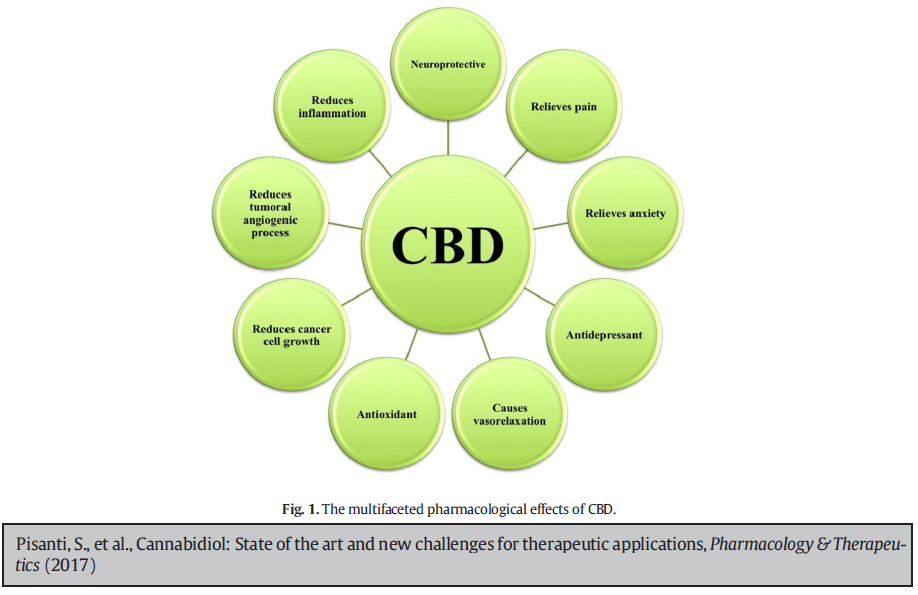
Selon une récente revue de la littérature, le CBD présente un réel potentiel thérapeutique car il présente à la fois des propriétés antidouleurs, anti-inflammatoires, anxiolytiques, antidépressives, antipsychotiques, antiépileptiques, neuroprotectives et anti-tumorales (Pisanti et al., 2017). Même si les études à la base de ces constats ont été principalement réalisées sur des modèles animaux, quelques études chez l’être humain sont prometteuses et différents essais cliniques ou programmes de recherche sont actuellement en cours. Pourtant, pour diverses raisons économiques et idéologiques, l’industrie pharmaceutique n’a jusqu’à ce jour manifesté que peu d’intérêt pour les molécules issues des plantes de cannabis, alors que certaines propriétés thérapeutiques sont connues depuis de nombreuses décennies. En effet, elle ne propose que le Sativex® (un spray buccal composé de THC et de CBD), dont la prescription n’est actuellement remboursée en Belgique que pour les personnes atteintes de sclérose en plaques qui répondant à certaines conditions[1]. Pourtant, de son côté, l’OMS considère que le CBD ne présente pas de dangerosité (faible toxicité, pas de tolérance, pas de potentiel d’abus) et en souligne le potentiel thérapeutique (WHO, 2017). Au Royaume-Uni, le CBD est considéré comme un médicament depuis 2017, ce qui devrait favoriser le développement de nouveaux produits pharmaceutiques à base de cette molécule. Ainsi, la société britannique GW Pharmaceuticals a réalisé des essais cliniques concluants sur un médicament à base de CBD (Epidiolex®), dans le cadre de la mise sur le marché d’un médicament permettant de traiter les épilepsies rebelles aux traitements classiques. Ce nouveau médicament est autorisé aux Etats-Unis depuis juin 2018. D’autres essais cliniques sur un cannabinoïde apparenté au CBD (la cannabidivarine ou CBDV) sont actuellement en cours. Actuellement, comme tous les nouveaux produits pharmaceutiques à faible spectre commercial, les médicaments à base de cannabinoïdes sont commercialisés à des prix très élevés (la boîte de 3 sprays de 10ml de Sativex® coûterait 440 euros hors remboursement selon la liste des prix de l’INAMI). Leur accessibilité pour les personnes malades dépend donc fortement de leur remboursabilité. Ce spectre commercial pourrait toutefois être revu et élargi vu les potentialités thérapeutiques de certains cannabinoïdes.
Le CBD semble avoir un potentiel thérapeutique pour des indications variées. En revanche, il n’existe actuellement aucune preuve scientifique solide selon laquelle les produits à base de CBD constitueraient une substitution efficace aux produits à base de THC. Les deux molécules ayant des profils pharmacologiques distincts, il est peu probable que le CBD puisse servir de substitution au THC, au même titre que la méthadone se substitue à l’héroïne. Les produits à base de CBD pourraient néanmoins, dans une certaine mesure, servir d’alternatives pour les personnes qui consomment ou souhaitent consommer du cannabis à des fins thérapeutiques sans vouloir être exposés à ses effets psychotropes[2]. Enfin, signalons que des essais cliniques sont actuellement en cours de manière à vérifier si les produits à base de CBD peuvent faciliter le sevrage au cannabis psychotrope, mais à notre connaissance les résultats n’ont pas encore été publiés, à l’exception de quelques analyses de cas encourageantes (voir par exemple Crippa et al., 2013 ; Shannon & Opila-Lehman, 2015).
[1] Selon l’agence fédérale des médicaments et des produits de santé, le Sativex® est indiqué dans le traitement des symptômes liés à une spasticité modérée à sévère due à une sclérose en plaques (SEP) chez des patients adultes n’ayant pas suffisamment répondu à d’autres traitements antispastiques et chez qui une amélioration cliniquement significative de ces symptômes a été démontrée pendant un traitement initial. Le Sativex® est uniquement remboursé dans cette indication et en cas de délivrance en pharmacie hospitalière sur prescription d’un neurologue.
[2] Certains effets thérapeutiques du cannabis, en particulier les effets analgésiques, semblent maximiser lors de l’association de CBD et de THC. Par conséquent, il est possible que certains effets thérapeutiques du cannabis ne puissent jamais être atteints par la prise seule de CBD.
Références
Crippa, J.A., Hallak, J.E., Machado-de-Sousa, J.P., Queiroz, R.H., Bergamaschi, M. et al. (2013). Cannabidiol for the treatment of cannabis withdrawal syndrome: a case report. Journal of Clinical Pharmacology and Therapeutics, 38, 162-164.
Pisanti, S., Malfitano, A.M., Ciaglia, E., Lamberti, A., Ranieri, R., et al., (2017). Cannabidiol: State of the art and new challenges for therapeutic applications. Pharmacology & Therapeutics, 175, 133-150.
Shannon, S., & Opila-Lehman, J. (2015). Cannabidiol Oil for Decreasing Addictive Use of Marijuana: A Case Report. Integrative Medecine, 14, 31-35.
WHO (2017). Cannabidiol (CBD). Pre-Review report. Luxembourg: World Health Organization.
Zuardi, A.W., Crippa, J.A.S., Hallak, J.E.C., Bhattacharyya, S., Atakan, Z., et al. (2012). A Critical review of the antipsychotic effects of cannabidiol: 30 years of a translational investigation. Current Pharmaceutical Design, 18, 5131-5140.